|
Der 1859 von Panté entwickelte Bleiakkumulator setzte sich damals
schon sehr schnell durch. Der Bleiakkumulator ist der einzige Akku, bei dem
beide Elektroden aus dem selben Material bestehen. Noch heute dominiert der
Bleiakku das Feld der Starter- ,Traktions- und Notstrombatterien. Die
Weltproduktion von Starterbatterien allein liegt zwischen 50 und 100 Mio. Es
stecken heute schon ca. 70% des auf der ganzen Welt vorhandenen Bleis in
Akkumulatoren.
Aufbau und Funktionsweise des Bleiakkus
Die heutigen Bleiakkus bestehen aus einzelnen
Zellen, wobei jede Zelle für sich eine Galvanische Zelle mit einem
Elektrodenpotential von 2V darstellt, meist sind dann 3 oder 6 solche Zellen
hintereinander geschaltet, um eine Spannung von 6 bzw. 12V zu erreichen. Eine
solche Halbzelle besteht aus einer Elektrode aus metallischem Blei und einer
Elektrode, die mit Blei(IV)-oxid beschichtet ist.
Als Elektrolyt dient 20-40% H2SO4, da bei dieser Konzentration die H2SO4 ihre
optimale Leitfähigkeit erreicht hat. Um die Elektrodenoberfläche möglichst Groß
zu halten, sind die an den Elektroden wirksamen Stoffe feinkörnig und porös.
Beim Entladevorgang funktioniert der Bleiakku als galvanische Zelle. Beim
Anlegen eines Verbrauchers, lösen sich Pb2+-Ionen aus beiden Elektroden und
gehen in die Lösung über.
Die hierbei entstandenen Pb2+-Ionen reagieren mit den Säurerestionen der H2SO4
zu schwerlöslichem PbSO4, dass sich an den Elektroden absetzt.
Das Entladen ist insgesamt ein freiwillig verlaufender Redoxprozeß. Beim
Entladen entsteht also an beiden Elektroden Bleisulfat, Schwefelsäure wird
verbraucht und es entsteht Wasser.
Es sinkt die Dichte der Säure bei diesem Prozess von 1,26 g/cm3 auf 1,18 g/cm3,
man ist demnach in der Lage, den Ladezustand des Akkus mit Hilfe der Säuredichte
zu bestimmen. Wenn man bei einer Dichte von 1,15 g/cm3 nicht nachlädt, wird der
Akku irreversibel beschädigt. Der Akku ist erschöpft, wenn das gesamte Bleioxid
reduziert wurde.
Der Ladevorgang ist ein erzwungener Vorgang, bei dem man eine Spannung an die
Elektroden anlegt und so die Stromrichtung umkehrt wird. Man könnte erwarten,
dass der Bleiakku als Elektrolytzelle funktioniert, da schwefelsaure Lösung
unter Bildung von Wasserstoff und Sauerstoff elektrolysiert werden würde.
Auf Grund von Überspannungen wird dies so stark behindert, sodass bevorzugt Pb2+
-Ionen an den Elektroden reagieren. Das macht das Aufladen überhaupt erst
möglich.

Der
Nickel/Cadmiumakkumulator
|
Vorteile des Ni-Ca-Akkumulators:
Hohe spezifische Energie (50 Wh/Kg)
An Robustheit kaum zu übertreffen
Wesentlich längere Lebensdauer als Bleiakkus
1000 - 2000 Lade- und Entladezyklen
vollständige Entladung schadet ihm nicht
fast beliebig lange Lagerung im entladenen Zustand, ohne dass er
Schaden nimmt
bleibt bei -30 bis -40°C noch funktionsfähig (jedoch mit Einbußen)
|
Nachteile des Ni-Ca-Akkumulators:
etwas höherer Preis
schnelle Selbstentladung
besteht zu 20% aus hochgiftigem Cadmium
Memory- und Lazy-Battery-Effekt
|
Praktisch verwendbare NiCd-Systeme gibt es erst seit
der Jahrhundertwende.
Nachdem sich Thomas A. Edison in seinen Forschungen auf Nickel / Eisen- Systeme
konzentrierte, schuf Waldemar Jungner 1899 den ersten später in Serie
gefertigten NiCd-Akku. Gasdichte NiCd- Zellen konnten erst nach 1933 hergestellt
werden, nachdem A.Sassler mit seinen Forschungen die Grundlage dafür gelegt hat.
Seinerzeit war auch schon das Prinzip der Sinterelektroden bekannt.
Der nächste Technologiesprung Mitte der 80'iger Jahre brachte dann die
Metallschaumelektrode und einige weitere Verbesserungen. Damit war es gelungen,
in den Abmessungen einer Mignonzelle eine Kapazität von über 1 Ah
unterzubringen.
Wohl einer der Hauptvorteile von NiCd- Systemen sind vor allem lange
Lagerfähigkeit im entladenen Zustand, sowie die Tiefentladefähigkeit. Natürlich
ist auch die größere mechanische Stabilität und das gute Verhältnis von Masse
(Gewicht) zu Kapazität zu erwähnen. Cadmium besitzt das Formelzeichen Cd und
gehört wie Blei zu den Schwermetallen. Daher sind alle Cd-Verbindungen sehr
giftig. Nickel besitzt das Formelzeichen Ni und gehört ebenfalls zu den
Schwermetallen.
Aufbau und Funktionsweise einer NiCd-Zelle
In einer NiCd-Zelle besteht die positive Elektrode
aus Nickelhydroxid (NiO2H), in der Regel mit einem Graphitzusatz um
dieLeitfaehigkeit zu verbessern. Bei gasdichten NC-Zellen ist es heute allgemein
üblich, einen Anteil sogenannter antipolarer Masse als Umpolschutz, meist
Cadmiumhydroxid ( Cd (OH)2) hinzuzufügen.
Die positive Nickel-Elektrode lässt sich nämlich viel schlechter Laden als die
negative Cadmium-Elektrode. Der Zusatz von Cadmiumhydroxid bildet eine
Ladereserve, welcher die Wasserzersetzung und somit die Bindung von
Wasserstoffgas verhindert.
Die Chemische Umwandlung des Wasserstoffs durch Oxidation an der positiven
Elektrode verläuft so langsam, das er für Rekombinationszwecke in der Zelle
nicht brauchbar ist. Dieser Wasserstoff- Überschuss, der zu einem Druckanstieg
in der Zelle führen würde, nimmt die Ladereserve auf und sorgt gleichzeitig für
einen gewissen Umpolschutz. Die negative Elektrode besteht aus pulverisierten
Cadmiumverbindungen.
Auch hier befinden sich zur Verbesserung der elektrischen Leitfähigkeit
eingelagerte Graphitpartikel, auch hier gibt es analog zu positiven Elektrode
eine Entlade - und Ladereserve, welche dadurch realisiert wird, dass mehr
Elektrodenmasse als eigentlich erforderlich verwendet wird.
Bei Überladung wird dann der gesamte Ladestrom zur Sauerstoffreduktion an der
negativen Elektrode verwendet ohne dass es zu einem unzulässigen Druckanstieg
kommt.
Trotz all dieser Maßnahmen hat natürlich die Umpolfestigkeit auch ihre Grenzen.
In Grosserienfertigung werden die Elektrodenmaterialien in die gewünschte Form
gepresst und dann zur mechanischen Stabilisierung mit einem feinmaschigen
Nickeldraht umgeben. Dieses leitfähiges Nickelnetz dient auch zur gleichmäßigen
Ladungsverteilung.

NiCd - Sinter- Zellen
Etwas aufwändiger und teurer sind Nick-Akkus mit
Sinterfolien-Elektroden.
Hierbei dient ein vernickeltes Stahlgewebe als Träger, auf welches das
Elektrodenmaterial, also NiOOH = positive Elektrode u. Cd = negative Elektrode,
staubförmig aufgebracht wird. Unter sehr hohen Temperaturen und Drücken sintern
dann diese Stoffe zusammen und ergeben eine raue Oberfläche. Durch die nun sehr
große aktive Oberfläche, ergeben sich folgende Eigenschaften:
sehr geringer Innenwiderstand, hohe Entladeströme und eine gute
Überladefestigkeit, da ja durch die große Oberfläche die Gase (O und H) bei
Überladung sich besser an den Elektroden binden können.
Des weiteren besitzen solche Akkus bis zu 20 % mehr Kapazität.

Der Nickel-Metallhybridakku
|
Vorteile des NiMH-Akkus:
Cadmiumfrei (umweltschonend!)
Höhere Energie von 50-70 Wh/Kg
Weist ähnliche Spannung wie NC-Zellen auf
Hohe Lebensdauer (bis 2000 Zyklen)
Ladewirkungsgrad bis zu 92%, dazu noch eine rel. kurze Ladezeit
Geringe Wartung benötigt
|
Nachteile des Ni/MH-Akkus:
Hoher Preis
Hochstromentladung max. 3C
Schnelle Selbstentladung
Starke Ausdehnung der Kristallgitter beim Ladevorgang daraus folgt
eine Verringerung der Lebensdauer
Irreversible Oxidation der H2-Speicherlegierungen
Memory Effekt
|
Die Nickel-Metallhydrid-Batterie entstand bei
der Suche nach einer Zelle mit vergrößerter Kapazität und verbesserter
Umweltverträglichkeit. Die Negative, strukturell recht einfache
Cadmium-Elektrode wurde hier durch eine Metalllegierung mit komplexer Struktur
ersetzt, die Fähig ist, Wasserstoff zu absorbieren.
Das Legierung-Wasserstoff-System weist eine hohe Energiedichte auf, was erlaubt
die Masse der negativen Elektrode zu verringern und das gewonnene Volumen mit
positiver Masse aufzufüllen.
Dadurch erhöht sich die Energiedichte im Vergleich zu NiCD-Zelle.
Aufbau und Funktionsweise einer Ni-MH Zelle
Die
Anode (-) besteht hier nicht aus Cadmium, sondern aus einer
wasserstoffspeichernden Nickellegierung. Die Kathode besteht wie schon beim
Ni/Cd-Akku aus Nickel.
Auch das Elektrolyt ist das selbe, und zwar Kaliumhydroxid-lösung.
Beim Entladen laufen allgemein folgende Reaktionen ab:
MH + NiOOH -> M
+ Ni(OH)2
Es entsteht eine Leerlaufspannung von 1,25 bis 1,35 V. Sie ist
vom Ladezustand, der Lagerungszeit und der Temperatur abhängig. Umittelbar nach
der Ladung kann auch mal 1,45V gemessen werden.
Die Nennspannung beträgt dennoch 1,2 V (ein Mittelwert der Spannungen im
Arbeitszyklus).
Die Entladeschlussspannung beträgt 1V, bei höheren Entladeströmen kann sie auch
auf 0,9V fallen.
Der Maximale Entladestrom beträgt nur 3C.
Die
NiMH-Zellen sind nur eingeschränkt für unsere Zwecke brauchbar, da der maximale
Entladestrom mit 3C vergleichsweise gering ist.
Brauchbar sind die Zellen jedoch für den „Next Generation“, der im Schwebeflug
weit weniger als 1A verbraucht. Bei den Indoor- und Parkflyeren wird der
Spitzenstrom zu hoch sein und die Zellen beschädigen.

Wiederaufladbare Lithium-Systeme
Das
Element Lithium wurde 1817 in einigen Mineralien entdeckt, und aufgrund seines
Vorkommens ausschließlich in Gesteinen
(griech. lithos =Stein) wurde es ent-sprechend benannt.
Als Metall ist es zuerst im Jahre 1855 durch Schmelzfußelektrolyse des
Lithiumchlorids hergestellt worden.
Aufgrund seiner physikalisch-chemischen Eigenschaften ist Lithium für die
Batterieindustrie sehr attraktiv:
Es besitzt das höchste elektrochemische Äquivalent aller Metalle und das höchste
negative Standardpotential. Die große Reaktivität erschwert jedoch erheblich die
industrielle Anwendung; es reagiert sehr heftig mit Wasser, wobei sich
Lithiumhydroxid (LiOH) bildet.
Der dabei freigesetzte Wasserstoff kann sich durch die Reaktionswärme entzünden
(u.U. auch explosiv), so dass die Verarbeitung in sog. Trockenräumen erfolgen
muss.
Aus den gleichen Gründen ist die einfache Zellenkomposition mit wässrigen
Elektrolyten unmöglich.
Es gibt bereits mehrere verschiedene Zellentypen, die jedoch keine eindeutigen
Vorteile gegenüber den klassischen NiCd-Systemen in allen Anwendungsbereichen
haben: entweder ist die Lebensdauer zu kurz, oder die Arbeitsbedingungen sind zu
exotisch.
(z.B. muss in manchen Lösungen die Temperatur höher als 120 °C sein), oder die
Ströme sind so gering, dass die Batterie z.B. nur in Herzschrittmachern
einsetzbar ist.
In Laboratorien gibt es bereits vielfältige Lösungen, und die Entwicklung geht
weiter - die Fachpresse berichtet monatlich über
neue Systeme!
Grundsätzlich gibt es fünf verschiedene Kategorien der Lithiumzelle:
Zellen mit flüssigem, organischen Elektrolyten:
Festkörperkathode aus Einlagerungsverbindungen, Anode aus metallischem
Lithium und flüssigem, organischen Elektrolyten.
Merkmale:
Hohe
spezifische Energiedichte
Mittlere Entladungsströme
Mögliche Sicherheitsprobleme (metallisches Lithium)
Niedrige Lebensdauer
Niedrige Selbstentladung
Beispiele: Li/MoS2, Li/MnO2, Li/TiS2, Li/NbSe3, Li/V2O5, Li/LiCoO2,
Li/LiNiO2.
Zellen mit festem Elektrolyten:
Festkörperkathode aus Einlagerungsverbindungen, Anode aus metallischem Lithium
und Elektrolyt aus festem Polymer.
Merkmale:
Hohe
spezifische Energiedichte
Niedrige Leitfähigkeit des Elektrolyten (kleine Entladungsströme)
Sicherere Konstruktion als bei flüssigem Elektrolyt
Sehr schlechte Eigenschaften bei niedrigeren Temperaturen
Niedrige Selbstentladung
Beispiel: Li/PEO-LiClO4/V6O13
Lithium-Ionen-Zellen:
beide Elektroden aus Einlagerungsverbindungen und flüssigem oder festem
Polymer-Elektrolyten.
Merkmale:
Sicherer Aufbau
Hohe Lebensdauer
Relativ große Selbstentladung
Mittlere Entladungsströme
Beispiele: LixC/LiCoO2, LixC/LiNiO2, LixC/LiMnO4
Zellen mit anorganischem Elektrolyten:
flüssige Kathode, die gleichzeitig als Lösungsmittel des Elektrolyten dient.
Merkmale:
Hohe
spezifische Energiedichte
Hohe Entladungsströme
Sehr gute Lagerungsfähigkeit
Widerstandsfähigkeit gegen Überladung
Sicherheitsprobleme (sehr giftig)
Kapazitätsverlust im Laufe des Lebens
Beispiele: Li/SO2, Li/CuCl2
Lithium-Legierungs-Zellen:
Anode aus Lithium-Legierung, flüssiger organischer Elektrolyt,
verschiedene Kathoden.
Merkmale:
Knopfzellenkonstruktion
Mehr Sicherheit durch Lithium-Legierung
Niedrige Energiedichte
Kurze Lebensdauer (außer für geringere Entladungstiefe)
Beispiele: LiAl/MnO2, LiAl/V2O5, LiAl/C, LiC/V2O5, LiAl/Polymer
Die
einzige Zelle aus der Lithium-Familie die für uns in frage kommen könnte ist die
Lithium-Ionen Zelle.
Sie besitzt eine extrem hohe Kapazität und eine hohe Zellspannung von 3,7V.
Widriger weise beträgt die Maximale Belastbarkeit nur 2C. Da die Kapazität der
Zellen entsprechender Größe jedoch über 1000mAh beträgt, reichen hier 2C für den
„Next Generation“ aus.
Leider
ist der Anschaffungspreis extrem hoch.

Eigenschaften der Beschriebenen Akkusysteme
|
System |
Blei-Säure |
NiCd |
NiMH |
Li-Ion |
|
Anode |
Pb |
Cd |
MH |
LixC6 |
|
Kathode |
PbO2 |
NiOOH |
NiOOH |
LiCoO2(LiMn2O4) |
|
Nominale Zellspannung [V] |
2,0 |
1,2 |
1,2 |
3,7 (3,5) |
|
Arbeitsbereich |
2,0-1,6 |
1,25-1,0 |
1,25-1,0 |
4,1-2,7 |
|
Grenzwert Entladeschlussspannung [V] |
1,6 |
0,8 |
0,9 |
2,5 |
|
Max. Entladestrom [C] |
10 |
20 |
2-3 |
2 |
|
Energiedichte-gravim. Wh/kg |
30-40 |
40-60 |
50 |
100 (125) |
|
Slebstentladung bei 20° in %NK/Monat |
8 |
15 |
25 |
10 |
|
Verwendbarkeit Jahre |
4-8 |
4-15 |
KA |
KA |
|
Zyklenfestigkeit bei 100% Entladung |
200-300 |
300-700 |
300-600 |
500 (1000) |

|
Zusammenfassung
Lithium-Ionen-Akku
Die Lithium-Ionen (Li-Io)
Technologie ist das neueste auf dem Gebiet der wiederaufladbaren Akkus.
Sie ermöglicht kleinere und leichtere Akkus bei größerer Leistung und
ist im Gegensatz zu Ni-Cd-Akkus und
Ni-MH-Akkus unanfällig für den sog.
Memory-Effekt
Nikel-Cadmium-Akku
Die Nikel-Cadmium
(Ni-Cd) Technologie ist die älteste der 3 Akkuarten. Ni-Cd-Akkus sind
sehr schwer, nicht sonderlich Leistungsfähig und sehr anfällig für den
Memory-Effekt.
|
Nikel-Metall-Hydride-Akku (Bericht von Panasonic)
Die
Nikel-Metall-Hydirde (Ni-MH) Technologie ist die derzeit am
verbreitetste Akkuart. Diese Akkus sind kleiner, leichter und
Leistungsfähiger als ihre Ni-Cd Kollegen aber ebenfalls anfällig für den Memory-Effekt.
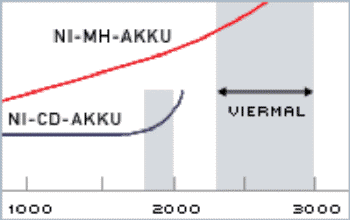
Ein NiMH (Nickel-Metallhydrid) Akku ist einerseits ein
neuartiger Akku, der kein toxisches Schwermetall enthält und
somit umweltfreundlich ist. Man spricht in diesem
Zusammenhang auch von einem sog. "grünen" Akkupack.
Andererseits besitzt ein 3,5 Ah NiMH Akku eine bis zu 75%
größere Ladekapazität als herkömmliche NiCd Akku-Packs. Das
heißt: Sie können mit Hilfe dieser neuen Akku-Packs bis zu 75% mehr
Arbeitsvorgänge durchführen - bei gleichen Außenabmessungen des Akkus.
|
 |
1. Vierfach genauere Temperatur-Erfassung
und -regelung: Keine Beschädigung des Akkus durch
automatische Abschaltung des Ladegerätes bei Erreichen der
maximalen Ladekapazität.
2. Optimale Möglichkeit zum Schnellladen von
Ni-MH-Akkupackes: Die Kühlung des Akkus während des
Ladevorgangs erfolgt durch kleine Öffnungen auf der
Rückseite des Akku-Packs, die einen Wärmeaustausch
ermöglichen.
3. Duales Ladeprogramm/Doppelte Microprozessorleistung:
Ladesystem für Ni-Cd und Ni-MH.
4. Die Umkehr-Technologie des Ladegeräts: Hohe
Leistungsabgabe des Ladegeräts.
FRAGEN UND ANTWORTEN
Warum können
Nickel-Metallhydrid-Akkus nicht mit herkömmlichen
Ladegeräten aufgeladen werden?
Antwort: Jeder Akkutyp hat seine eigenen Eigenschaften. Die
Art des Temperaturanstieges während des Ladevorganges ist
bei Ni-Cd und NiMH Akku-Packs verschieden. Daher ist es
notwendig, bereits geringfügige Temperaturänderungen zu
erkennen und das Steuersystem entsprechend zu verändern.
Warum gibt es Löcher im Gehäuse der
Ni-MH Akkus?
Antwort: Eine der Eigenschaften der Ni-MH Akkus besteht
darin, dass die Temperatur während des Ladevorganges
ansteigt. Um die Verringerung der Akku-Lebensdauer aufgrund
hoher Temperaturen zu vermeiden, ist es notwendig, den Akku
während des Ladevorganges zu kühlen. Dies geschieht durch
die Dies geschieht durch die Luftschlitze an der Rückseite
des Akkus.
Wenn es in den Ni-MH Akkupacks Löcher
gibt, besteht da nicht die Gefahr, dass diese bei Regen
beschädigt werden?
Antwort: Aufgrund der Löcher im Gehäuse des Akkupacks
besteht keine Gefahr eines Defektes durch den Eintritt von
Wasser. Dennoch sollten Ni-MH-Akkupacks - wie auch die
herkömmlichen Ni-Cd-Akkus - nicht unnötigerweise dem Kontakt
mit Wasser ausgesetzt werden.
Was geschieht, wenn sie bei kaltem
Wetter benutzt werden?
Antwort: Da sich die chemischen Reaktionen in dem Akku bei
sehr niedrigen Temperaturen verlangsamen, sind die Akkupacks
nicht in der Lage ihre volle Leistung zu erbringen. Wir
empfehlen daher die Akkus bei Temperaturen von weniger als 0
Grad vor ihrem Gebrauch kurz aufzuladen, damit diese sich
erwärmen und dann ihre optimale Leistung erzielen können.
Wie beeinflusst die Verwendung eines
Ni-MH-Akkus die Leistung eines Werkzeuges, wenn man ihn
anstelle eines Ni-Cd-Akkus verwendet?
Antwort: Ni-MH Akkus geben gegen Ende der verwendbaren
Ladung eine stabilere Leistung ab.
Memory-Effekt
Unter dem
Memory-Effekt versteht man eine Eigenschaft, die nur bei Ni-Cd- und Ni-MH-Akkus zu
finden ist. Bei diesen beiden Akkutypen ist es sehr wichtig, sie vor dem
Wiederaufladen komplett zu entleeren. Wird der Akku mehrfach in
nichtleerem Zustand nachgeladen tritt der sog. Memory-Effekt in Kraft.
Das bedeutet, daß sich der Akku nur noch an die nachgeladene Kapazität
erinnert und nicht mehr an seine Gesamtkapazität, was zu Folge hat, daß
der Akku immer schwächer wird.Der
Memory-Effekt und der Lazy-Battery-Effekt, sind die beiden häufigsten
Ursachen für ein versagen eines Ni/Cd -Akkus. Es gibt verschiedene
Ursachen für den Memory-Effekt, dies sind z.B.:
 Verschmutzte Kontakte oder das auftreten eines Wackelkontaktes Verschmutzte Kontakte oder das auftreten eines Wackelkontaktes
 Zu hohe Umgebungstemperaturen, da bei über einer Temperatur von 45°C
der Ladewirkungsgrad sinkt Zu hohe Umgebungstemperaturen, da bei über einer Temperatur von 45°C
der Ladewirkungsgrad sinkt
 Nicht vollständiges aufladen Nicht vollständiges aufladen
 Und in erster Linie eine häufige Überladung sowie eine mangelnde
Entladung Und in erster Linie eine häufige Überladung sowie eine mangelnde
Entladung
Der klassische Memory-Effekt bewirkt ein Absinken der Spannung um 0,2V.
Die Ursache hierfür ist die Bildung einer sog. Hume-Rothery-Phase auf
der negativen Elektrode, d.h. die Bildung einer intermetallischen
Verbindung Ni5Cd27.
Pro Ni-Atom wird ziemlich viel Cadmium gebunden, das hat zur Folge, dass
die gespeicherte Energie nur bei einer geringen Spannung verfügbar ist.
Die Bildung der Phase kann jedoch durch vollständiges Ent- und Aufladen
rückgängig gemacht werden.
Lazy-Battery-Effekt
Die meisten heutigen Ni/Cd -Akkus weisen keinen Memory-Effekt mehr auf.
Der Lazy-Battery-Effekt ist aber ein würdiger Vertreter und stellt die
Wissenschaftler vor ein neues Problem. Wenn Ni/Cd -Akkus ungenügend
beansprucht und sie nach häufigen Teilentladungen ständig überladen
werden, werden sie ,,faul". Ein Spannungsabfall von 0-30mV gegenüber dem
Normalwert tritt auf.
Der Grund hierfür ist die Bildung von großen Kristallen an der
Cadmiumelektrode(-).
Auch der Innenwiderstand wird hierbei stark erhöht. Dieses Problem
tritt vor allem bei wenig gebrauchten Geräten auf, z.B. wenn die
Batterie häufig geladen aber kaum entladen wird. Dies kann schon nach
wenigen Monaten zum totalen Versagen der Batterie führen. Ein
Lösungsansatz für das Problem ist die Entwicklung von intelligenten
Ladegeräten, die ein Überladen verhindern sollen.
Tipps zum richtigen Umgang mit Akkus
|

|
Akkus entladen sich, wenn sie nicht gebraucht
werden. Außerdem halten Akkus, die regelmäßig genutzt
werden, länger. Sie sollten sich deshalb überlegen, ob
sich für Sie der Kauf der immer noch recht teuren Akkus
lohnt. |
|

|
Warme Akkus entladen sich
schneller. Deshalb sollten sie bei sommerlicher
Hitze gegebenenfalls im Kühlschrank aufbewahrt
werden |
|

|
Wenn Sie sich ein Akkuladegerät zulegen, achten Sie
auf die Unterstützung von NiCad und NiMH.
Billig-Ladegeräte können teilweise nur einen Akkutyp
vernünftig laden. Von Vorteil sind Ladegeräte, die sich
automatisch abschalten, wenn die maximale Ladung
erreicht ist. |
|

|
Bei älteren oder billigen Ladegeräten, die sich
nicht automatisch ausschalten, errechnen Sie die
Ladezeit mit folgender Formel: Akku-Kapazität geteilt
durch gelieferten Strom des Ladegeräts, multipliziert
mit 1,4. |
|

|
NiCad-Akkus, die nicht mehr die volle Kapazität
haben, lassen sich unter Umständen durch mehrmaliges
Laden und Entladen "auffrischen". |
|

|

